Van massamedicijn naar maatwerk: hoe de precisiegeneeskunde aan een opmars bezig is
De patiënt van de toekomst zal steeds vaker een doelgericht geneesmiddel krijgen. Aan dat precisiewerk hangt wel een stevig prijskaartje.
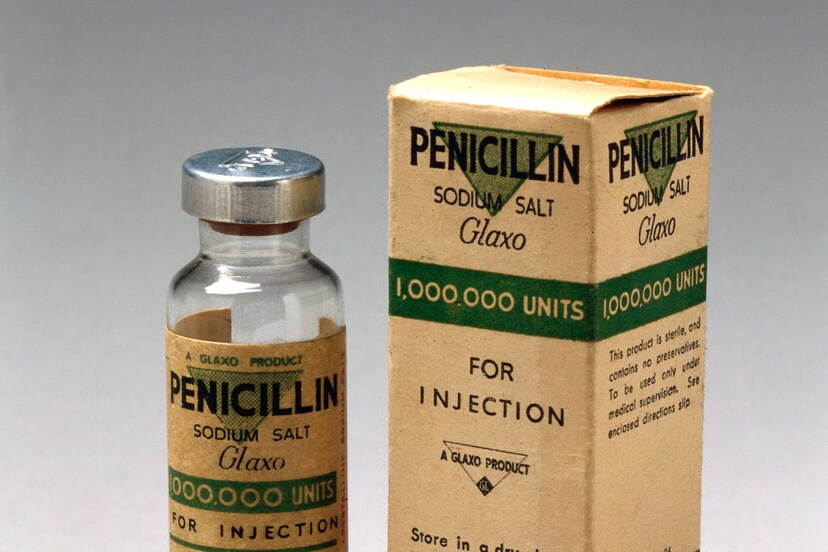
Arts en microbioloog Alexander Fleming doet in 1928 bij toeval een ontdekking die de geneeskunde revolutionair verandert en miljoenen levens zal redden. Tijdens de kweek van bacteriën raakt zijn glasplaat per ongeluk vervuild met een schimmel, eentje van de soort Penicillium, en tot zijn verbazing ziet hij dat in de buurt van de schimmel geen bacteriën groeien. Hij slaagt erin om de bacteriedodende stof uit de schimmel te isoleren en geeft die stof de naam penicilline. Daarmee heeft hij het eerste antibioticum in handen. De stof blijkt lastig te isoleren en is slecht houdbaar en daardoor duurt het nog ruim tien jaar voordat het antibioticum in massaproductie kan worden genomen.
Een kleine eeuw nadat Fleming een stof had ontdekt waarmee infecties konden worden bestreden, is de geneeskunde radicaal van koers veranderd. Was de penicilline van Fleming, het allereerste antibioticum, bestemd voor de massa, dan zijn de medicijnen die nu worden ontwikkeld steeds vaker maatwerk. De precisiegeneeskunde rukt op, de patiënt van de toekomst zal steeds vaker een doelgericht geneesmiddel krijgen.
One size fits all, dat was heel lang de standaardaanpak in de medische wereld: alle patiënten kregen hetzelfde medicijn, waarvan het effect gebaseerd was op een gemiddelde. Maar een doorsneemens bestaat niet: een middel dat bij de ene patiënt blijkt te werken, kan bij een ander niet effectief zijn en zelfs bijwerkingen veroorzaken. Van alle geneesmiddelen tegen kanker helpt driekwart uiteindelijk niet, van antidepressiva knapt slechts een derde van de patiënten op.
Individueel genetisch profiel
Daarom hebben de artsen van de 21ste eeuw een veel krachtiger uitvalsbasis: het bouwplan van het menselijk lichaam. Die weg werd geplaveid toen wetenschappers bijna twintig jaar geleden het complete menselijk genoom ontrafelden en DNA-onderzoek daarna in sneltempo goedkoper werd. Toen het mogelijk werd om van patiënten een individueel genetisch profiel op te stellen, kwamen er steeds meer doelgerichte medicijnen op de markt, waarmee een specifiek kenmerk van een ziekte kon worden aangepakt.
De afgelopen jaren zijn er al ruim 130 precisiemedicijnen op de markt gekomen; bij ruim 40 procent van alle medicijnen die nu worden ontwikkeld is sprake van personalized medicine. Dat betekent niet dat er nu opeens geneesmiddelen beschikbaar zijn voor individuele patiënten, benadrukt Toine Pieters, hoogleraar geschiedenis van de farmacie aan de Universiteit Utrecht. “De term wekt ten onrechte die verwachtingen. Het gaat om geneesmiddelen die gerichter werken en maar bij een klein deel van de patiënten effectief zijn, patiënten die de genetische kenmerken van een ziekte met elkaar delen. Maar laten we ons niet rijk rekenen; ook de genetica wordt statistisch onderbouwd, wat erop neerkomt dat ook de effectiviteit van de nieuwe medicijnen uitgaat van een gemiddelde.”
Toch is Pieters enthousiast over het toenemende maatwerk. Omdat daardoor de juiste patiënt het juiste medicijn krijgt en zinloze bijwerkingen kunnen worden voorkomen. Chemo, de belichaming van de ‘one size fits all’-aanpak, blijft bijvoorbeeld nog altijd noodzakelijk, maar bij vooral longkanker en melanoom (huidkanker) zijn de sombere prognoses verbeterd door de komst van de nieuwe middelen, die zich richten op een bepaalde signatuur van de tumor.
Daar hangt wel een prijskaartje aan: de komst van al die nieuwe, gepatenteerde medicijnen heeft de uitgaven aan geneesmiddelen de afgelopen tien jaar doen exploderen, zegt Pieters. Omdat het nieuwe type geneesmiddelen maar bij een kleine groep patiënten werkt, verdienen farmaceuten hun investeringen minder makkelijk terug, wat de prijzen opstuwt.
Stamcellen
De toekomst zal, alleen al om financiële redenen, van het maatwerk nóg meer maatwerk moeten maken. Een bijzondere oplossing komt uit Nederland, uit het Hubrecht Instituut van stamcelbioloog Hans Clevers, waar wetenschappers miniorganen kunnen kweken uit stamcellen. Door het medicijn in het lab toe te voegen aan die organoïden kan per patiënt worden voorspeld of een medicijn effectief is. Neem cystic fibrose (taaislijmziekte), een ziekte waarvoor sinds kort medicijnen op de markt zijn die bij patiënten met bepaalde genetische mutaties de oorzaak van de ziekte in de cellen kunnen aanpakken. Die medicijnen zijn peperduur, terwijl bekend is dat lang niet alle patiënten er baat bij hebben. Met behulp van de Utrechtse techniek kan de selectie worden gemaakt. “Dat is nu echt een voorbeeld van individuele geneeskunde”, zegt Pieters.
Duidt dat op een toekomst waarin ook voor steeds meer veel voorkomende ziekten een persoonlijke aanpak zal opduiken? Pieters denkt van niet. “Omdat we risico’s steeds minder acceptabel vinden, hebben we het nu ook al over voorstadia van ziekten die behandeld schijnen te moeten worden. Zo neemt het aantal patiënten gestaag toe. Er zijn zelfs gezonde mensen die preventief een polypil slikken om later onheil te voorkomen. Nee, daar zie ik echt nog heel weinig personalized medicine hoor.”
